في اكتشاف جديد أجرته جامعة كيوشو اليابانية، اكتشف الباحثون دورا حيويا للكالسيوم في التخلص من الخلايا الميتة داخل الأنسجة الواقية لجسم الإنسان، يعد هذا الاكتشاف خطوة مهمة نحو فهم كيفية حفاظ الجسم على نظافة وسلامة الأسطح الخارجية والداخلية وحمايتها من العدوى، يكشف البحث عن آلية يتم فيها استخدام الكالسيوم لمساعدة الخلايا المجاورة على التخلص من الخلايا الميتة بسرعة، مما يضمن سلامة الحاجز الواقي.
اكتشاف آلية خلوية جديدة
قام فريق من الباحثين في جامعة كيوشو باكتشاف عملية تعتمد على الكالسيوم وتلعب دورا أساسيا في إزالة الخلايا الميتة، وهو ما يساهم في تحسين فهمنا لكيفية حفاظ الجسم على صحته ومنع الأمراض. نُشرت نتائج هذا البحث مؤخرا في مجلة Current Biology، حيث أظهرت أن مستويات أيونات الكالسيوم تلعب دورًا أساسيًا في التخلص الفعّال من الخلايا الميتة، والمعروفة باسم الخلايا المبرمجة للاستماتة (Apoptotic Cells)، من الأنسجة الظهارية، وهي الخلايا التي تشكل الأغشية الواقية على أسطح الجسم. استخدم الفريق الثقافات الخلوية المعدلة وراثيًا إلى جانب تقنيات التصوير المتقدمة لدراسة هذه العملية بالتفصيل.
الحواجز الحيوية والدفاع الخلوي
تشكل الخلايا الظهارية غطاءً خارجيا وداخليا لأجسامنا، بما في ذلك الجلد والأعضاء الداخلية، حيث تعمل كحواجز واقية أساسية. عندما تتعرض هذه الخلايا للتلف وتموت، في عملية تعرف باسم الاستماتة، تتعاون الخلايا المجاورة بسرعة لطرد الخلايا الميتة وإغلاق أي فتحات قد تنشأ. يساعد هذا الإجراء في منع دخول المواد الضارة التي قد تسبب العدوى أو الالتهابات. وعلى الرغم من أن هذه العملية أساسية للحفاظ على سلامة الحواجز الظهارية، إلا أن التفاصيل الدقيقة لهذه الآليات لم تكن مفهومة بالكامل حتى هذا الاكتشاف.
قاد هذا البحث البروفيسور جونيتشي إيكنوتشي وفريقه البحثي، بما في ذلك الدكتور كينجي ماتسوزاوا والسيد يوما تشو، بالتعاون مع باحثين من جامعة طوكيو وجامعة علوم الصحة في هوكايدو.
آلية الاستجابة للكالسيوم (CaRE)
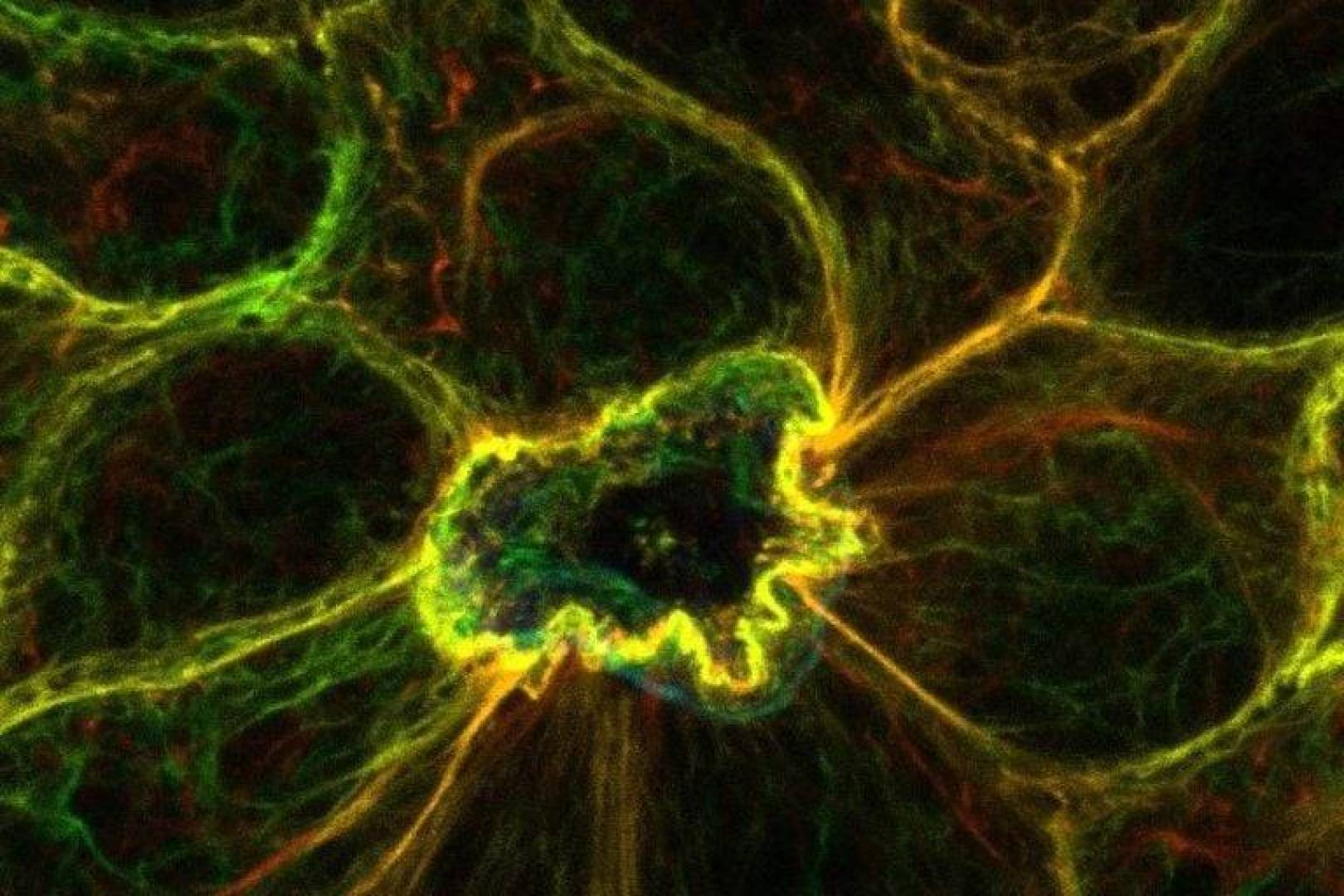
بدأ الفريق بتعريض الخلايا الظهارية الفردية للاستماتة باستخدام الليزر المركز، ثم رصدوا استجابة الخلايا المجاورة لها. باستخدام مسبار خاص لمراقبة أيونات الكالسيوم يدعى GCaMP6، تمكن الباحثون من متابعة تغيرات الكالسيوم في الوقت الفعلي. وقد لاحظوا أن الخلايا المجاورة للخلايا الميتة أظهرت زيادة كبيرة في مستويات الكالسيوم، خصوصا بالقرب من مناطق الغشاء التي تتلامس مع الخلايا الميتة. أطلق الباحثون على هذه الظاهرة الجديدة اسم الاستجابة للكالسيوم في فعّالات الطرد القمي (CaRE).
دور مستقبلات IP3 والديسموسومات في إزالة الخلايا
تعميقا في هذه الآلية المكتشفة حديثا، قام الفريق بدراسة دور مستقبلات IP3، وهي بروتينات داخل الخلايا تساعد في تنظيم مستويات أيونات الكالسيوم. وجدوا أن تعطيل نشاط هذه المستقبلات أو إزالة الجينات المرتبطة بها يؤدي إلى منع طرد الخلايا الميتة بشكل كامل. أظهرت التحليلات باستخدام المجهر الإلكتروني المتقدم أن نوعا محددا من مستقبلات IP3، وخاصة تلك القريبة من الوصلات الخلوية المعروفة بـ الديسموسومات، يلعب دورا رئيسيا في آلية CaRE.
تُعتبر الديسموسومات هياكل تربط الخلايا ببعضها البعض وتعمل كأزرار تثبتها معًا. تكون هذه الهياكل حيوية في الأنسجة مثل الجلد وبطانات الأعضاء، حيث تساهم في الحفاظ على استقرار ووظيفة الأنسجة. وجد الفريق أن تنشيط مستقبلات IP3 بالقرب من الديسموسومات ضروري لتحفيز انقباض مجموعة من البروتينات المعروفة باسم مجمع الأكتوميوسين، مما يساعد الخلايا على تغيير شكلها والحركة، مما يسهل إزالة الخلايا الميتة.
أوضح البروفيسور إيكنوتشي أن "دراستنا تسلط الضوء على دور جديد لمستقبلات IP3 في الديسموسومات، والتي كان يُعتقد سابقا أنها تقتصر على الروابط الميكانيكية بين الخلايا الظهارية."
الاستنتاجات وآفاق المستقبل
نظرًا لأن هذه الدراسة أجريت على خلايا مزروعة في المختبر، يشير الفريق إلى الحاجة إلى المزيد من التحليل لآلية CaRE للتحقق من إمكانية حدوث هذه الآلية في الكائنات الحية وما إذا كانت تختلف بين أنسجة الأعضاء المختلفة، أو ما إذا كانت هناك عوامل أخرى تلعب دورا في هذه العملية.
بشكل عام، تعزز هذه الدراسة فهمنا لكيفية الحفاظ على صحة الأنسجة الظهارية في الجسم، وهو أمر غالبا ما نعتبره أمرا مسلما به. يختتم البروفيسور إيكنوتشي قائلاً: "توفر نتائجنا رؤى قيمة لفهم الأمراض الناتجة عن اضطرابات في الحاجز الظهاري، مثل التهاب الجلد التأتبي ومرض الأمعاء الالتهابي، وقد تساهم في تطوير إجراءات وقائية وعلاجات جديدة للالتهابات المزمنة."